Đề bài
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitrogen đã phản ứng là 15%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu?
-
A.
20% và 80%.
-
B.
16,67 và 83,33%.
-
C.
25% và 75%.
-
D.
40% và 60%.
Phương pháp giải
Dựa vào kiến thức về Sản xuất Ammonia.
Lời giải của GV Loigiaihay.com
Gọi số mol ban đầu của N2 và H2 lần lượt là x; y.
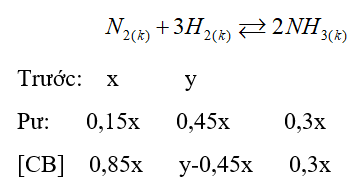
\(\frac{{{P_t}}}{{{P_s}}} = \frac{{{n_t}}}{{{n_s}}}\)=> \(\frac{{{P_t}}}{{0,95{P_t}}} = \frac{{x + y}}{{0,7x + y}}\) => 0,7x + y = 0,95(x + y)
=>y = 5x
%nN2 = \(\frac{x}{{x + y}}.100\% = \frac{x}{{x + 5x}}.100\% \)= 16,67%
%nH2 = 100% - 16,67% = 83,33%
Đáp án : B

Các bài tập cùng chuyên đề